
30岁,2008年05月30日,一个三十岁的“男孩”走了。
他的名字叫:Lorenzo Odone 罗伦佐 奧登,他就是那部電影《罗伦佐的油》(Lorenzo’s Oil)的主人公。
5岁前,罗伦佐是一个能够说3种语言的好动男孩,和父亲奥古斯都、母亲米凯拉在东非摩罗群岛居住,父亲奥登是世界银行(World Bank)经济学家。
5岁,1984年5月时,罗伦佐突然似发疯般狂叫,送去医院,才知晓得了少见的遗传性疾病 ALD,即“脑白质退化症”。
病名:Adrenoleukodystrophy,简称ALD
病因:因X染色体基因缺陷,体内缺乏某种酵素,导致超长链饱和性脂肪酸无法正常代谢,沉积在大脑白质和肾上腺皮质,进而侵蚀脑神经的髓鞘质,妨碍神经传导。
遗传模式:由母亲遗传给儿子,发生率约为两万至五万分之一。
病程发展:多在3至5岁发病,患者听力退化,进而视力不佳、走路不稳、语言能力逐渐丧失,进入瘫痪状态,一般在10岁前死亡。
这种病有多可怕?它的症状出现在孩童时期,病情出现时会狂叫、暴躁,慢慢地失去说话能力、行动能力,接着瘫痪、抽搐,丧失吞咽能力和呼吸能力,甚至周期性地全身疼痛、抽搐,最后痛苦地死去。而从病发到死亡,最多只有两年的生存期限。

7岁,面对这样的疾病,许多家庭都选择了放弃。但奥登夫妇并没有,他们开始寻求途径治疗罗伦佐,奥登夫妇甚至自己开始研读医学,在不到两年时间里解开了医学界都还未破解的病因,并且研究出了一种特殊配方的油,缓解病情,这就是之后造福了“脑白质退化症”患者的罗伦佐的油。
罗伦佐的油(Lorenzo's oil)是三油酸甘油酯(glycerol trioleate)与三芥子酸甘油脂(glycerol trierucate)的4:1比例的混合物。这种油,其实就是我们吃的“菜籽油”提炼而成。
奥古斯都·奥登取得此油剂在美国的专利,编号5,331,009号。专利权所得用来支付髓鞘再生研究计划(The Myelin Project),此计划目标在研究ALD与相似病症的治疗方法。被美国食品与药物管理局(Food and Drug Administration, FDA)认为是实验性治疗。
14岁,故事被拍成电影《罗伦佐的油》,,导演竟然是拍摄过《疯狂的麦克斯》系列的乔治·米勒,查了下,发现其早年在新南威尔斯大学医学院学习,还正式当过临床医生因爱好电影,1971年参加短期电影研习班,才开始电影生涯。又是一个医生的电影梦!还好整部影片,拍出了医生、患者、科学家、药企、协会、FDA这复杂的充满人性碰撞的“父母就是药神”

24岁,2000年,熬过千禧年,母亲米凯拉因为多年来不眠不休地照顾罗伦佐,让她的身体日渐衰弱,终于无法再支撑下,因肺癌61岁之龄去世。

30岁,2018年6月1日,在生日的第二天,罗伦佐走了,他已经在父母对罗伦佐的爱及坚持不懈,比医生预期多活22年。
5年后,2013年10月24日,为抢救儿子生命而投入心力研发〝罗伦佐油〞的慈父奥登在故乡意大利辞世,享年80岁。
而罗伦佐的油,其父母创立髓鞘再生研究计划(The Myelin Project),仍然再给更多的病患家庭带来尊严与希望。
在感叹这对“药神”父母同时,我们更应该看到,即使在美国,这种脑白质退化症,因为发生率约为两万至五万分之一,由于治疗罕见病的药物适用人群少、市场需求少、研发成本高,很少有制药企业进行研发生产,这就是我们医药行业常说的“罕见病药”,俗称“孤儿药”。
那么如果在我国罗伦佐们的“油”在哪里?
罕见病患者药费负担沉重
中国罕见病发展中心对Orphanet罕见病数据库的梳理,截至2016年,全球罕见病数量达6930种。而据不完全统计,中国有约2000万罕见病患者。
一些罕见病价格高昂,使得患者倍感压力。由病痛挑战基金会与香港浸会大学、华中科技大学联合发布的《2018中国罕见病调研报告》显示,罕见病患者平均承担医疗开支的70%~80%,还有很多罕见病病人并非无药可用,而是因为药费过高而难以承担。
罕见病目录此前首次发布
2018年6月8日,国家卫生健康委员会、科技部、工信部、药监总局、中医药管理局5部门联合公布《第一批罕见病目录》。首批目录纳入了血友病、白化病等121种疾病,因冰桶挑战活动被社会公众熟知的罕见病“渐冻人症”——肌萎缩侧索硬化也被纳入。据统计,首批进入目录的121种罕见病中,目前有40多种已经有批准上市的治疗药物,而其中在国内上市的仅20多种。
目录将加速孤儿药在国内的上市,国内药企也将比以往更有积极性去自主创新研发孤儿药,为罕见病患者提供更多、有效、可负担的治疗手段,从而改善罕见病患者的生活质量。
业内人士认为,目录的出台将提高药企对罕见病用药的研发积极性,加快罕见病药品上市进程,从而改善罕见病患者的生活质量,并将为罕见病药物纳入医保提供参考依据。
科研机构和药物研发企业可以有的放矢,针对目录中的疾病开展药物研发。对药监、医保等政府部门来说,纳入目录内的病种在优先审评审批、免临床试验或有条件审批等方面具有了依据,对未来制定和完善罕见病相关医疗保障制度也提供了参考。
2000万患者的福祉,减税来了
2019年2月11日,国务院总理李克强主持召开国务院常务会议,部署加强癌症早诊早治和用药保障的措施,并决定对罕见病药品给予增值税优惠。
其中在罕见病方面,会议指出,要保障2000多万罕见病患者用药。从3月1日起,对首批21个罕见病药品和4个原料药,参照抗癌药对进口环节减按3%征收增值税,国内环节可选择按3%简易办法计征增值税。
国家药品监督管理局局长焦红在今年1月17日至18日召开的全国药品注册管理和上市后监管工作会议上表示,要加快临床急需和罕见病治疗药品的审评审批,制定鼓励药物研发创新的政策。
孤儿药立法与革新
笔者建议,在“罕见病药”领域,可以更多的借鉴欧美的成熟经验,尤其在立法上。
1983年,美国颁布了“孤儿药法案”(Orphan Drug Act,OCA),对孤儿药的开发公司给予经济上的激励措施。乃美国国会基于保障在美国罹病人数低于 20 万疾病的病患能有药可医治而提出的鼓励措施,凡获得孤儿药资格新药,给予临床试验支出抵税和减免处方药使用者费用(Prescription Drug User Fee),以及最后获准上市,如果该药厂可证明新药比其他相同适应症疗法的临床效果更佳时,有机会获得 7 年市场专属期。
孤儿药研发激励措施:
1.市场独占期
美国:批准后7年的市场独占期
欧盟:批准后10年的市场独占期
2.研发成本减免
美国:研发费用50%的税收抵免,I期-III期临床试验拨款(2008-2012年每个项目3000万美元),免除使用者付费
3. 优先审评券
开发罕见儿科疾病的孤儿药的制药公司,可获得优先审评券,将新药审评时间从标准的10个月缩短至6个月,该券可以出售给其他药企使用,也可以自己使用。
该法案的实施,极大地促进了孤儿药的开发。在1983年OCA颁布之前,总共只有38个专门用于罕见病的药物在美国获批。而法案实施后,超过200家制药公司已经把将近450种孤儿药推向了市场,200多种罕见病有了治疗药物。
孤儿药资格实施以来的确嘉惠众多罕见疾病病患,但也有漏洞和被滥用的争议,最主要漏洞之一为获得孤儿药资格的新药可豁免儿童族群的临床试验。长年来,孤儿药资格允许授予常见疾病中的儿童族群为目标适应症的新药,借此鼓励儿童用药发展。然而,因后来立法的 Pediatric Research Equity Act(PREA),获得孤儿药资格新药或以儿童族群为适应症标的获得孤儿药资格时,反而可豁免 PREA 的要求,而无需进行以儿童族群为研究对象的临床试验,此意料外的效应,反可能让儿童用药研究数量下降,与 PREA 立法目的相违背。
美国 FDA 已于 2017 年 12 月 19 日发布「Clarification of Orphan Designation of Drugs and Biologics for Pediatric Subpopulations of Common Diseases」指引草稿,拟透过行政手段填补此漏洞。基于指引草稿推出的具体措施为,将儿童孤儿药资格的适用范围从一般疾病的年龄,切割缩减为药厂需证明该疾病发生在成人或儿童实质上为不同的疾病,或此儿童族群已在罕见病患族群的范围。
自 1983 年以来,核发超过 600 个孤儿药资格,其中约 70 款具孤儿药资格的药品被美国 FDA 核准的第一适应症病患族群其实相当庞大,例如治疗高类固醇的 Crestor、精神病药物 Abilify、用于诸多自体免疫疾病的 Humira 与癌症药物 Hercptin 等。
虽然有诸多的漏洞和被滥用的争议,但是本着当初立法的目的。美国 FDA 局长 Scott Gottlieb 表示,为了因应越来越多标靶药物提出孤儿药资格申请,将会举办公开会议搜集相关建议,以确保后续美国 FDA 对孤儿药资格的核发。美国 FDA 现在孤儿药的审查政策先朝向给予更有效率的保障来发展,透过组织与流程的改善,对孤儿药资格的申请案力求 90 天内给予答覆,以利节省孤儿药开发的时程与时间。让更多的罗伦佐们能够得到救治,这才是孤儿药制度创立的初心。
相对于欧美等发达国家的各种“孤儿药”法规和开发激励措施,中国对于罕见病还没有明确的定义和立法,制药企业还是把研发重点放在患者群大,能进入医保的常见疾病药物上,对开发和生产孤儿药的积极性不高。
不过这个情况有望得到改变。早在2011和2012年,上海和山东青岛等地,就针对罕见病的医保和社会救助进行了一些积极有益的探索。而进入2016年以来,国家对这一疾病类型日益重视,发布了一系列的文件。
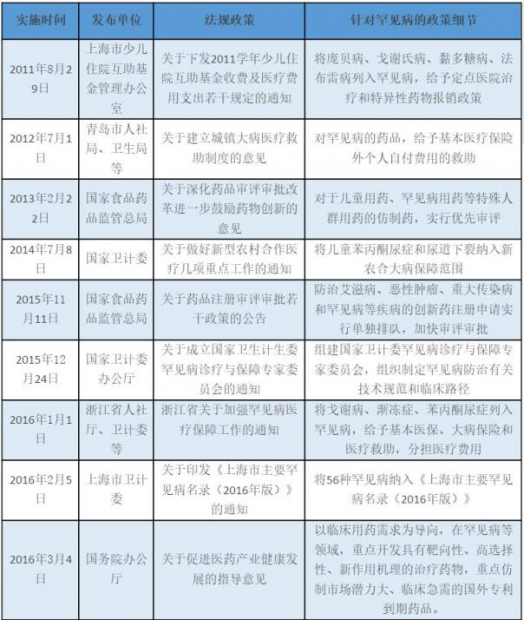
孤儿药制度,在我看来,就是“沙盒监管”模式的医药版本,如何在医药研发创新中更好的救治、更快的救治,找到最好的平衡点,这才是立法者、监管者必须要时刻牢记的初心。
看来,2019,我们的“药神”已来了,罗伦佐的“油”快有了!
0
推荐




 京公网安备 11010502034662号
京公网安备 11010502034662号 